Répandre du fer dans l’océan pour doper le phytoplancton ne serait d’aucune efficacité au niveau global, assure une nouvelle étude du MIT. Car les micro-organismes ont besoin d’une « soupe d’ingrédients » complexe pour absorber ce fer et se développer. Un subtil équilibre qu’ont modélisé les chercheurs, et qui ne serait pas du tout évident à modifier.
au sommaire
Fertiliser l'océan avec du ferfer n'aura aucun impact sur la croissance du phytoplancton au niveau global, affirme une nouvelle étude du MIT parue dans la revue PNAS. Et pour cause : « la quantité totale de fer dont les micro-organismesmicro-organismes ont besoin est déjà parfaitement équilibrée », assure Jonathan Lauderdale, chercheur au département des sciences de la terre, de l'atmosphère et des planètes du MIT et principal auteur de l'étude.
Fertiliser l’océan avec du fer, une vieille idée séduisante sur le papier
L'océan absorbe 30 % des émissions de carbone issues des émissionsémissions humaines, grâce à deux mécanismes : la dissolution dans l'eau du CO2 et la photosynthèse. Cette dernière est effectuée par le phytoplancton, les microalgues qui transforment le CO2 en oxygène. Or, cette pompe biologique ne fonctionne pas à pleine efficacité dans de vastes régions de l'océan, appelée zones HNLC (high-nitrate, low-chlorophyll), en raison notamment d'une carencecarence en fer. C'est le cas par exemple de l'océan Austral. Des expériences de fertilisation artificielle menées sur de petites échelles (100 à 300 km2) ont montré que l'ajout de fer augmentait effectivement l'activité biologique dans la couche surface, et donc la photosynthèse. D'où l'idée d'étendre cette méthode à l'ensemble de l'océan afin d'absorber davantage de CO2.

Le problème, c'est qu'il ne suffit pas de déverser du fer dans l'eau pour qu'il soit immédiatement absorbé par le phytoplancton. Car en réalité, la majorité du fer coule rapidement au fond de l'océan sans être utilisé. Afin d'être maintenu en surface et de pouvoir être absorbé par le phytoplancton, le fer doit se lier à certains composés organiques appelés ligandsligands. Ces ligands, eux-mêmes produits par le phytoplancton, proviennent de déchets organiques, de cellules mortes ou de sidérophores, des moléculesmolécules fabriquées par les micro-organismes pour se lier au fer. Une grande « soupe d'ingrédients » qu'ont modélisée les chercheurs du MIT.
Une grande soupe de ligands, fer et macronutriments
Jonathan Lauderdale et ses collègues ont divisé les océans du globe en plusieurs grandes zones, chacune possédant un équilibre différent en ligands, fer et macronutriments (azoteazote et phosphatephosphate) pour étudier l'équilibre général du système. L'océan Austral, par exemple, est riche en macronutriments mais présente une faible teneur en fer étant donné sa grande distance par rapport aux sources de poussière continentale. À l'inverse, l’Atlantique Nord est riche en fer et pauvre en macronutriments. Les chercheurs ont simulé la circulation générale entre ces environnements et découvert que le système était déjà parfaitement équilibré.

« Les océans ayant des concentrations élevées en fer ont également des concentrations élevées en ligands, ce qui permet au phytoplancton de se développer et produire plus de ligands. À l'inverse, dans les océans à faible concentration en ligands, le phytoplancton dispose de moins de fer et a donc une activité biologique réduite, ce qui entraîne une moindre consommation de macronutriments », décrivent les auteurs. Fertiliser artificiellement les zones pauvres en fer stimulerait temporairement la croissance de phytoplancton et l'absorptionabsorption de macronutriments, mais ces derniers ne seraient du coup plus disponibles pour circuler dans d'autres régions, comme l'Atlantique Nord qui dispose des ligands nécessaires à l'absorption du fer. « Le résultat net serait une diminution éventuelle du phytoplancton dans l'Atlantique Nord, ce qui aboutirait à une amélioration nulle de l'absorption de CO2 au niveau mondial », concluent les auteurs.
Fertiliser des océans, un projet déjà hautement controversé
D'autres conséquences néfastes pourraient en outre se faire sentir. « Nous devons considérer l'océan comme un système interconnecté, explique Jonathan Lauderdale. Si le phytoplancton dans l'Atlantique Nord devait chuter, il en serait de même pour toute la vie marine en amont de la chaîne alimentairechaîne alimentaire qui dépend des organismes microscopiques ». De précédentes études avaient déjà souligné les dangers de cette méthode de géo-ingénierie. Une étude de 2007 parue dans Nature et dirigée par Stéphane Blain, du laboratoire d'océanographie et de biogéochimie de Marseille (CNRS) montrait ainsi que la fertilisation naturelle en fer de l'océan Austral est 10 à 100 fois plus efficace que la fertilisation artificielle. En 2010, une équipe américano-canadienne indiquait que l'ajout de fer provoquait la sécrétion de toxines par certaines microalgues. Il semble bien que cette piste ait définitivement du plombplomb dans l'aile.
Enrichir l'océan Austral avec du fer ne serait peut-être pas si efficace
Article du CNRS publié le 15/11/2014
Quelle serait la réponse de l'écosystèmeécosystème marin à un enrichissement naturel en fer ? Plus complexe et moins efficace à long terme, du point de vue du stockage du dioxyde de carbonedioxyde de carbone, que ce que l'on pensait jusque-là, selon une nouvelle étude réalisée dans l'océan Austral.
Comme tous les océans, l'océan Austral joue un rôle important en tant que puits de carbonepuits de carbone, en raison notamment de la présence de phytoplancton. Pour croître, ce dernier consomme en effet le dioxyde de carbone (CO2) dissous dans l'eau de mer. Et lorsqu'il meurt, il peut alors sédimenter au fond de l'océan et ainsi stocker une partie du dioxyde de carbone qu'il a absorbé, un processus que les scientifiques appellent la pompe biologique de carbone.
Bien que de nombreuses zones de l'océan Austral soient riches en nutrimentsnutriments favorisant la croissance du phytoplancton, elles manquent souvent de fer, ce qui limite cette croissance. Au cours des cinq dernières années, des études ont montré qu'un enrichissement naturel en fer de l'océan Austral pouvait provoquer une augmentation de l'exportation du dioxyde de carbone vers l'océan profond. Certains scientifiques pensent d'ailleurs que ce processus peut expliquer en partie les cycles qu'a connu le dioxyde de carbone atmosphérique au cours de l'histoire récente de la Terre. D'où l'idée que l'ajout de fer pourrait stimuler la croissance du phytoplancton et donc l'efficacité de la pompe biologique de carbone.

Les coquilles en carbonate de calcium finissent par produire du CO2
Cependant, le stockage net du dioxyde de carbone à l'intérieur de l'océan ne dépend pas que de la sédimentationsédimentation du phytoplancton. Ce dernier est en effet une source de nourriture pour certains types de brouteurs planctoniques à coquillescoquilles (foraminifèresforaminifères et ptéropodes) qui fabriquent leurs coquilles de carbonate de calcium selon un processus qui, à l'échelle du millier d'années, produit du CO2.
Pour la première fois, une équipe internationale comprenant des chercheurs du Lomic et du LPGN (Laboratoire d'océanographie microbienne, CNRS, UPMC et Laboratoire de planétologie et géodynamique de l'Université de Nantes), ont quantifié à l'aide de nouvelles observations, la production et la sédimentation de coquilles de carbonate de calciumcarbonate de calcium résultant de la prolifération naturelle de phytoplanctons qui se produit à proximité des îles Crozet dans l'océan Austral. Et leurs résultats sont surprenants.
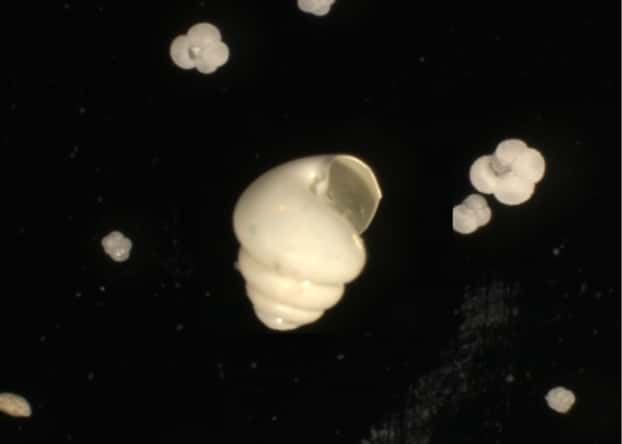
Estimer l'effet de l'enrichissement est une affaire complexe
En effet, ils ont montré que la fertilisation naturelle causée par le fer lessivé des îles Crozet, qui sont des îles basaltiquesbasaltiques, augmentait d'un facteur compris entre 7 et 10 la production et la sédimentation de coquilles de carbonate de calcium, alors que dans le même temps la sédimentation du phytoplancton dans l'océan profond n'augmentait que d'un facteur 3.
Cette forte croissance des coquilles de carbonate de calcium de l'écosystème, qui est une source de dioxyde de carbone à l'interface océan-atmosphère à de grandes échelles de temps (100 à 1.000 ans), réduirait ainsi d'environ 30 % l'efficacité à long terme de l'enrichissement en fer par rapport à ce que l'on pensait jusqu'à présent.
Les chercheurs restent prudents et n'affirment pas que du fer délibérément ajouté, une stratégie envisagée pour atténuer le réchauffement climatiqueréchauffement climatique, aurait strictement le même impact. Mais ils estiment qu'ignorer la réponse de ces organismes pourrait entraîner une surestimation du stockage de dioxyde de carbone à long terme des océans après un tel ajout.
Les chercheurs ont également montré que la réduction de la capacité de stockage du dioxyde de carbone était due non seulement à une plus grande abondance de ces brouteurs planctoniques, mais aussi à des changements dans la composition de leurs différentes espècesespèces. Dans les échantillons prélevés dans les zones naturellement enrichies en fer, ils ont en effet trouvé davantage d'espèces produisant de grandes coquilles en carbonate de calcium et donc plus de CO2 par individu. L'enrichissement en fer pourrait donc affecter la biodiversitébiodiversité et la structure des écosystèmes, du moins dans cette zone spécifique de l'océan Austral car l'écologieécologie de ces organismes produisant des coquilles peut être très différente selon les espèces et la région océanique où ils se trouvent.
D'autres projets de recherche sont prévus qui viseront à étudier la sédimentation du phytoplancton et la production des organismes calcifiants dans d'autres régions océaniques naturellement enrichies en fer, l'océan Austral mais aussi l'océan ArctiqueArctique où la fontefonte de la glace de mer peut également affecter l'équilibre délicat des écosystèmes marins.
Ce qu’il faut
retenir
- Pour absorber le fer contenu dans l’eau, le phytoplancton a besoin de ligands, eux-mêmes issus de ce phytoplancton.
- Ajouter du fer dans les zones carencées ne serait d’aucune efficacité car cela priverait d’autres océans de macronutriments dont ils ont besoin.
- Les océans fonctionnent déjà dans un parfait équilibre général qu’il sera inutile et dangereux de perturber.